Différence entre la pression partielle et la pression de vapeur Différence Entre
termes scientifiques relatifs à la quantité de pression exercée par les composants du système, mais leur identité peut être source de confusion pour d'autres. Il existe une distinction claire entre ces termes, y compris leurs effets et leur identité. Cet article développera plus sur les différences entre ces termes. Il inclura également quelques exemples pour démystifier les applications de celui-ci.
Commençons par souligner le concept de pression avant de pouvoir creuser la distinction entre vapeur et pression partielle. La pression est scientifiquement définie comme la force appliquée par unité de surface sur un objet ou une substance. Il peut également être défini comme la force appliquée par les particules en collision les unes sur les autres et il est souvent mesuré en Pascal. Dans le cas d'une collision de particules, l'équation gazeuse et la théorie cinétique des gaz sont utilisées pour calculer la pression.
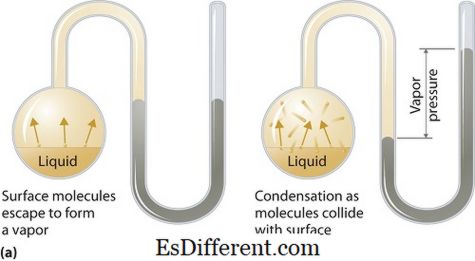
Qu'est-ce que la pression de vapeur?
La pression de vapeur peut s'appliquer aux phases liquides ou solides. C'est la pression exercée par la vapeur dans son équilibre thermodynamique sur son état liquide ou solide à une température donnée dans un système fermé lorsque la vapeur et le liquide (solide) sont en contact. Cette pression résulte de la vaporisation, qui est activée par une augmentation de la chaleur sur le solide ou le liquide. Ainsi, la température est utilisée comme mesure de vaporisation et elle est directement proportionnelle à la pression de vapeur. Cela signifie que plus la température est élevée, plus la pression de vapeur est élevée.
Pendant la vaporisation, les molécules d'air s'échappent du fait de l'énergie cinétique plus élevée de l'air dans un système fermé. Puis, à l'équilibre, la pression de vapeur se produit entre la vapeur et sa forme condensée de liquide (solide). Dans les solutions où les forces intermoléculaires sont plus faibles, la pression de vapeur a tendance à être plus grande et, inversement, dans les solutions où les forces intermoléculaires sont plus fortes, la pression de vapeur est moindre.
La pression de vapeur peut également se produire dans des mélanges idéaux, comme expliqué par la loi de Raoult. Il indique que la pression de vapeur partielle d'un composant particulier dans un mélange liquide ou solide est égale à la pression de vapeur de ce composant multipliée par sa fraction molaire dans ce mélange à une température donnée. L'exemple ci-dessous va illustrer cela.
Exemple 1.
Étant donné un mélange idéal de 0,5 mol. éthanol et 1,5 mol. méthanol avec la pression de vapeur de 30KPa et 52KPa, respectivement, déterminer la pression de vapeur partielle de chaque composant.
Solution:
Le nombre total de moles est de 1. 5mol + 0. 5mol = 2. 0mol. Selon la loi de Raoult, la pression de vapeur partielle est égale à la pression de vapeur multipliée par la fraction molaire de ce composant particulier.Dans ce cas, le P methanol = 1. 5/2 * 52 = 39KPa et P éthanol = 0. 5/2 * 30 = 7. 5KPa.
Lorsque vous avez les pressions de vapeur partielles des composants dans le mélange, vous pouvez obtenir la pression de vapeur totale en les ajoutant ensemble. A cet égard, 7. 5 + 39 donne 46. 5KPa de pression de vapeur totale du mélange de solutions d'éthanol et de méthanol.
Facteurs affectant la pression de vapeur
Identité des molécules
Comme déjà mentionné plus haut, les types de forces moléculaires déterminent la pression de vapeur à exercer. Si les forces sont plus fortes, la pression de vapeur diminue et, si elle est plus faible, il en résulte une pression de vapeur plus importante. Par conséquent, la composition du liquide ou du solide affectera la pression de vapeur.
Température
Une température plus élevée conduit à une pression de vapeur plus élevée car elle active plus d'énergie cinétique pour briser les forces moléculaires de sorte que les molécules puissent s'échapper rapidement de la surface du liquide. Lorsque la pression de vapeur (pression de vapeur saturée) est égale à la pression externe (pression atmosphérique), le liquide commence à bouillir. Une température plus basse se traduira par une faible pression de vapeur et il faudra du temps pour que le liquide bout.

Loi de Dalton sur les pressions partielles
Qu'est-ce que la pression partielle?
L'idée d'une pression partielle a été proposée pour la première fois par le célèbre scientifique John Dalton. Il a donné naissance à sa loi sur les pressions partielles qui stipule que la pression totale exercée par un mélange idéal de gaz est égale à la somme des pressions partielles des gaz individuels. Dites qu'un conteneur particulier est rempli de gaz hydrogène, azote et oxygène, la pression totale, P TOTAL, sera égale à la somme de l'oxygène, de l'azote et de l'hydrogène. La pression partielle de tout gaz dans ce mélange est calculée en multipliant la pression totale par la fraction molaire du gaz individuel.
En un mot, la pression partielle est la pression exercée par un gaz particulier dans le mélange comme s'il agissait seul dans le système. Ainsi, vous ignorez les autres gaz lors de la détermination de la pression partielle d'un gaz individuel. Cette théorie peut être vérifiée en injectant, par exemple, 0. 6atm de O 2 dans un récipient de 10. 0 L à 230K et en injectant ensuite 0. 4atm N 2 dans un récipient identique de la même taille à la même température, puis finalement combiner les gaz pour mesurer la pression totale; ce sera la somme des deux gaz. Ceci explique clairement la pression partielle d'un gaz individuel dans un mélange de gaz non réactifs.
Calcul de la pression partielle
Le calcul de la pression partielle est une brise absolue puisque la loi de Dalton [1] prévoit des dispositions pour cela. Cela dépendra des informations typiques fournies. Si, par exemple, la pression totale est donnée pour un mélange de gaz A et B ainsi que la pression du gaz A, la pression partielle de B peut être calculée en utilisant P TOTAL = P A + P B . Le reste est des manipulations algébriques. Mais dans le cas où seule la pression totale du mélange a été donnée, vous pouvez utiliser la fraction molaire du gaz B pour déterminer la pression partielle.La fraction molaire, notée X, peut être trouvée en divisant les moles de gaz B par les moles totales du mélange gazeux. Ensuite, pour trouver la pression partielle, vous allez multiplier la fraction molaire, X, par la pression totale. L'exemple ci-dessous explique cela.
Exemple 2.
Un mélange d'azote et d'oxygène, avec 2,5 moles et 1,85 moles, respectivement, est injecté dans un récipient de 0,20 litre avec une pression totale de 4 atm; calculer la pression partielle exercée par le gaz Oxygen.
Solution:
Le nombre total de moles dans le mélange est de 2. 5 + 1. 85 = 4. 35 moles. Ainsi, la fraction molaire de l'oxygène, X o , sera de 1. 85 moles / 4. 35 moles = 0, 425 moles. La pression partielle d'oxygène sera de 0. 425 * 4atm = 1. 7atm. La pression partielle du gaz résiduel peut être calculée suivant la même approche ou peut être calculée en utilisant le gaz Oxygène et la pression totale telle qu'élaborée par la loi de Dalton des pressions partielles que la pression totale des gaz non réactifs est égale à la somme des les pressions partielles.
Différence entre la vapeur et la pression partielle
D'après les explications ci-dessus, il apparaît que la pression de vapeur et la pression partielle sont deux pressions distinctes. La pression de vapeur s'applique aux phases liquides et solides tandis que la pression partielle s'applique à la phase gazeuse. La pression de vapeur est exercée en phase de transition après qu'une quantité suffisante de chaleur a été ajoutée à la solution, conduisant ainsi à l'échappement de ses molécules dans un système fermé.
La principale différence entre pression partielle et pression de vapeur est que la pression partielle est la pression exercée par un gaz individuel dans un mélange comme s'il était seul dans ce système, tandis que la pression de vapeur se réfère à la pression exercée par la vapeur dans son mélange. équilibre thermodynamique avec son état condensé de liquide ou de solide. Le tableau ci-dessous donne une comparaison concise de ces pressions.
| Pression de vapeur | Pression partielle |
| Elle est exercée par la vapeur liquide ou solide sur sa phase condensée à l'équilibre | Elle est exercée par des gaz individuels dans un mélange gazeux non réactif |
| Bien expliqué par Raoult Loi | Bien expliqué par la loi de Dalton |
| Applicable en phases solide et liquide | Applicable dans les phases gazeuses seulement |
| Indépendant de la surface ou du volume du système | Calculé en utilisant les gaz dans le même volume |
| Calculé en utilisant la fraction molaire du soluté | Calculé en utilisant la fraction molaire du gaz |
Wrap Up!
La pression de vapeur et la pression partielle sont deux termes scientifiques importants utilisés pour déterminer les effets des forces appliquées respectivement par la vapeur et les gaz dans un système fermé donné à des températures particulières. Leur principale différence est la zone d'application avec la pression de vapeur appliquée sur les phases liquides ou solides, tandis que la pression partielle est appliquée sur un gaz individuel dans un mélange de gaz parfaits dans un volume donné.
La pression partielle est calculée facilement en suivant la loi de Dalton sur les pressions partielles, tandis que la pression de vapeur est calculée en appliquant la loi de Raoult.Dans tout mélange donné, chaque composant de gaz exerce sa propre pression, appelée pression partielle indépendante des autres gaz. Et quand vous doublez les moles de n'importe quel composant avec la température restante constante, vous augmenterez sa pression partielle. Selon la relation Clausius-Clapeyron [2], la pression de vapeur augmente à mesure que la température augmente.
Avec les informations mentionnées ci-dessus, vous devriez être en mesure de faire la distinction entre la pression de vapeur et la pression partielle. Vous devriez également être capable de les calculer en utilisant les fractions molaires et en multipliant par la pression totale. Nous vous avons donné des exemples typiques pour élaborer sur l'application de ces pressions.


