Différence entre les métaux alcalins et alcalino-terreux
Métaux alcalins vs Métaux alcalins terreux < Comme les métaux alcalins et les métaux alcalino-terreux sont les deux premiers groupes du tableau périodique, la différence entre les métaux alcalins et les métaux alcalino-terreux est un sujet d'intérêt pour tout étudiant en chimie. Les métaux alcalins et les métaux alcalino-terreux sont également appelés éléments du "S-block" parce que les éléments de ces deux groupes ont leur ou leurs électrons les plus extérieurs dans le s-subhell.
En général, nous avons utilisé le mot «métal» pour les matériaux qui conduisent l'électricité; les métaux alcalins et les métaux alcalino-terreux sont de bons conducteurs électriques et thermiques. Les éléments de ces deux groupes sont les métaux les plus réactifs dans le tableau périodique. Leurs points de fusion sont relativement faibles par rapport à ceux des autres métaux. Les métaux alcalins et les métaux alcalino-terreux ont de nombreuses propriétés similaires, mais cet article traite principalement de leurs différences.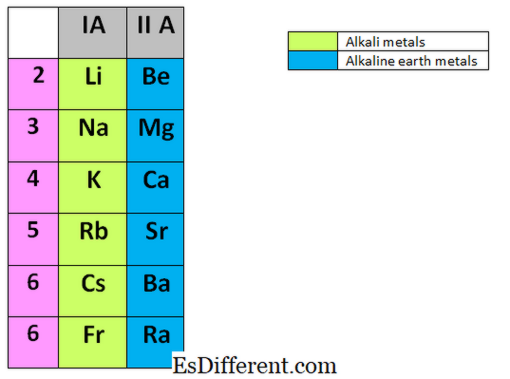
Les métaux alcalins sont les éléments trouvés dans le premier groupe du tableau périodique. Ils sont Lithium (Li), Sodium (Na), Potassium (K), Rubidium (Rb), Césium (Cs) et Francium (Fr). Ils sont tous des métaux et très réactifs et aucun de ces métaux ne se produisent pas en tant que métaux libres dans la nature. Les métaux alcalins sont toujours stockés dans des liquides inertes tels que le kérosène car ils réagissent rapidement avec l'air, la vapeur d'eau et l'oxygène de l'air. Parfois, ils réagissent de façon explosive avec d'autres substances. Ils peuvent facilement atteindre l'état gazeux noble, en éliminant l'électron le plus externe dans la coque de valence.
Les densités de lithium et de sodium sont inférieures à la densité de l'eau. Cependant, les autres éléments sont plus denses que l'eau. Beaucoup de composés de métaux alcalins (NaCl, KCl, Na 2 CO3, NaOH) sont très importants dans le commerce. Qu'est-ce qu'un métal alcalino-terreux?
Les métaux alcalino-terreux se retrouvent dans le deuxième groupe du tableau périodique. Les éléments du groupe II comprennent: Le Béryllium (Be), le Magnésium (Mg), le Calcium (Ca), le Strontium (Sr), le Baryum (Ba) et le Radium (Ra). Comme les métaux alcalins, ces éléments ne se produisent pas librement dans la nature et sont également très réactifs.
Tous les éléments de ce groupe sont plus denses que l'eau. Les métaux purs sont de couleur gris argenté, mais ils ont tendance à se décolorer rapidement lorsqu'ils sont exposés à l'air car ils forment une couche d'oxyde à la surface. Comme les métaux alcalins, ces métaux sont également de bons conducteurs en chaleur et en électricité.Tous les métaux alcalino-terreux ont une valeur commerciale.
Quelle est la différence entre les métaux alcalins et les métaux alcalino-terreux?
Configuration électronique
- : Les métaux alcalins ont la configuration électronique de [Noble gaz] ns 1 et les métaux alcalino-terreux ont une configuration électronique [Noble gaz] ns 2 . Valence
- : Tous les métaux alcalins ont un électron dans leur enveloppe la plus externe et tous les métaux alcalino-terreux ont deux électrons externes. Pour obtenir la configuration des gaz rares, les métaux alcalins doivent perdre un électron (la valence est «un»), alors que les métaux alcalino-terreux doivent éliminer deux électrons (la valence est «deux»). Réactivité
- : Les métaux alcalins et les métaux alcalins sont très réactifs. Les métaux alcalins sont plus réactifs que les métaux alcalino-terreux. Charge ionique
- : Les métaux alcalins ont une charge ionique +1 dans leurs composés et les métaux alcalino-terreux ont une charge ionique +2 dans les composés. Dureté
- : Les métaux alcalins sont très doux et peuvent être coupés avec un couteau bien aiguisé. Les métaux alcalino-terreux sont plus durs que les métaux alcalins. Sommaire:
Métaux alcalins vs métaux alcalino-terreux




