Différence entre les éléments du bloc S et P | S vs P éléments de bloc
vs. P éléments de bloc
La différence de clé entre les éléments de blocs s et p peut être mieux expliquée à l'aide de leur configuration électronique. Dans les s éléments de bloc, le dernier électron se remplit au sous-shell s et dans p éléments de bloc, le dernier électron se remplit au sous-shell p. Quand ils forment des ions; s les éléments de bloc suppriment facilement leurs électrons de la sous-coque la plus éloignée tandis que p les éléments de bloc acceptent les électrons au sous-shell p ou enlèvent les électrons du sous-shell p. Certains éléments du groupe p forment des ions positifs éliminant les électrons de la sous-couche p la plus externe et certains éléments (les éléments les plus électronégatifs) forment des ions négatifs acceptant un électron d'autres. Quand vous considérez les propriétés chimiques, il y a une différence significative entre les éléments de bloc s et p; c'est essentiellement dû à la configuration électronique.
Que sont les éléments S-block?
Les éléments S-block sont les éléments chimiques du groupe I et du groupe II du tableau périodique. Comme la sous-coque s ne peut accueillir que deux électrons, ces éléments ont généralement un électrons (groupe I) ou deux (groupe II) dans la coquille la plus externe. Les éléments du groupe I et II sont indiqués ci-dessus dans le tableau.
- diff Article Milieu avant Table ->| IA | II A | |
| 2 | Li | Be |
| 3 | Na | Mg |
| K | Ca | |
| 5 | Rb | Sr |
| 6 | Cs | Ba |
| 7 | Fr | Ra |
| IA | Métaux alcalins |
| II A | Métaux alcalino-terreux |
Tous les éléments du bloc s forment des ions positifs et sont très réactifs.
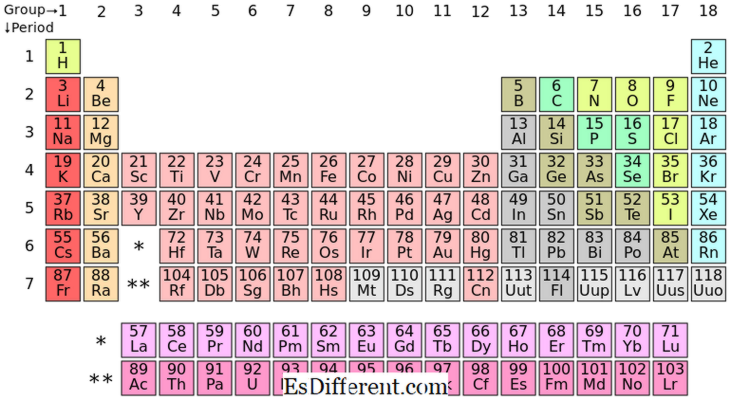
Le placement des éléments S-block dans la table périodique
Que sont les éléments P-block?
Les éléments P-block sont les éléments dont le dernier électron se remplit en p sous-coellule. Il y a trois p-orbitales; chaque orbitale peut accueillir deux électrons, ce qui fait le total de six électrons p. Par conséquent, les éléments p-block ont un à six électrons p dans leur enveloppe la plus externe. Le bloc P contient à la fois des métaux et des non-métaux; en plus il y a aussi des métalloïdes.
| 13 | 14 | 15 | 16 | 17 | 18 | |
| 2 | B | C | N | O | F | 3 |
| Al | Si | P | S | Cl | Ar | 4 |
| Ga | Ge | As | Se | Br | Kr | 5 |
| Sn | Sb | Te | I | Xe | 6 | |
| Tl | Pb Bi | Po | At | Rn | Quelle est la différence entre les éléments de bloc S et P? | Configuration des électrons communs: |
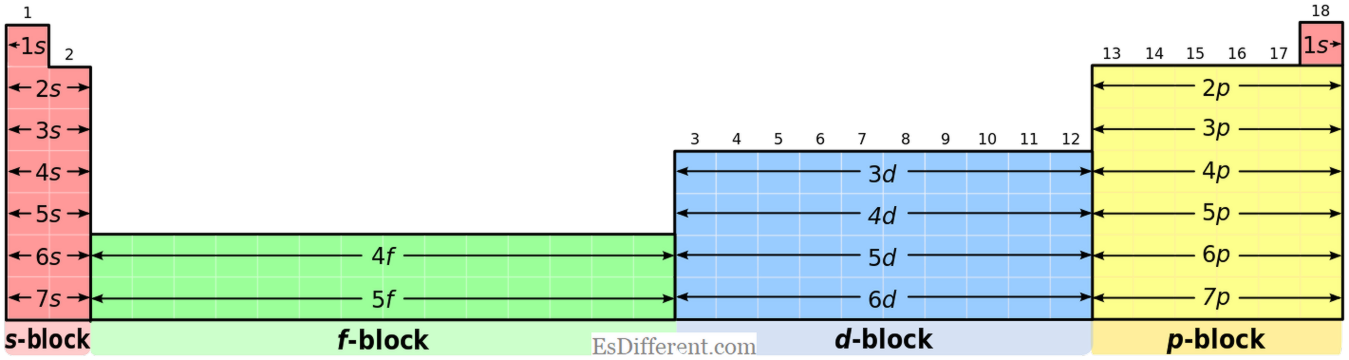
Eléments du bloc S:
Les éléments du bloc S ont la configuration électronique commune du [gaz noble] ns
1 (pour les éléments du groupe I)] ns 2 (pour les éléments du groupe II). Eléments du bloc P: Les éléments du bloc P ont la configuration électronique commune du [gaz noble] ns
2 np 1-6 . Mais, l'hélium a une configuration 1 2 ; c'est une situation particulière. Etats d'oxydation: Eléments du bloc S:
Les éléments du bloc S ne présentent pas d'états d'oxydation multiples, comme les éléments p-block. Par exemple, les éléments du groupe I montrent un état d'oxydation +1 et les éléments du groupe II montrent un état d'oxydation +2.
Eléments du bloc P: Contrairement aux éléments du bloc s, les éléments p-block ont un état d'oxydation commun pour leur groupe respectif dans le tableau périodique et d'autres états d'oxydation supplémentaires selon la stabilité de l'ion.
| 14 | 15 | 16 | 17 | 18 | Configuration électronique générale | |
| ns | 2 np 1 ns | 2 np 2 ns | 2 np 3 ns | 2 np 4 2 | n 5 n 2 | n 6 1 st |
| membre du groupe Be < C N | O | F | He | Numéro d'oxydation commun | +3 | +4 |
| +5 | -2 | -1 | 0 | Autres états d'oxydation | +1 | +2, -4 |
| +3, -3 | +4, +2, | +3, +5, 1, +7 | - | Propriétés: | Eléments du bloc S: | En général, tous les éléments du bloc s sont des métaux. Ils sont brillants, de bons conducteurs électriques et thermiques et faciles à enlever les électrons de la coquille de valence. Ce sont les éléments les plus réactifs du tableau périodique. |
Éléments P-block:
La plupart des éléments p-block sont des non-métaux. Ils ont des points d'ébullition bas, des conducteurs médiocres et des électrons difficiles à retirer de la coquille la plus externe. Au lieu de cela, ils gagnent des électrons. Certains des non-métaux sont des solides (C, P, S, Se) à température ambiante tandis que d'autres sont des gaz (Oxygène, Azote). Le brome est un non-métal, et c'est un liquide à température ambiante. De plus, p-block contient des éléments métalliques; de l'aluminium (Al), du gallium (Ga), de l'indium (In), de l'étain (Sn), du thallium (Tl), du plomb (Pb) et du bismuth (Bi).
Courtoisie d'image: 1. "Tableau périodique (polyatomique)" de DePiep [CC BY-SA 3. 0] via Commons
2. "Blocs de table périodique spdf (32 colonnes)" par Utilisateur: DePiep [CC BY-SA 3. 0] via Commons




