Différence entre 1s et 2s Orbital | 1s vs 2s Orbital
Différence clé - 1s vs 2s Orbital
L'atome est la plus petite unité de matière. En d'autres termes, toute matière est faite d'atomes. Un atome est composé de particules subatomiques, principalement des protons, des électrons et des neutrons. Les protons et les électrons forment le noyau, situé au centre de l'atome. Mais les électrons sont positionnés dans des orbitales (ou niveaux d'énergie) qui sont situés à l'extérieur du noyau d'un atome. Il est également important de noter que les orbitales sont des concepts hypothétiques qui sont utilisés pour expliquer l'emplacement le plus probable d'un atome. Il existe diverses orbitales entourant le noyau. Il y a aussi des sous-orbitales telles que s, p, d, f, etc. La sous-orbitale s est de forme sphérique lorsqu'elle est considérée comme une structure 3D. L'orbitale s a la plus forte probabilité de trouver un électron autour du noyau. Une sous-orbitale est à nouveau numérotée 1s, 2s, 3s, etc. en fonction des niveaux d'énergie. La principale différence entre l'orbitale 1 et 2 est l'énergie de chaque orbitale. 1s orbital a une énergie inférieure à l'orbitale 2s.
TABLE DES MATIÈRES
1. Vue d'ensemble et différence clé
2. Qu'est-ce que 1s Orbital
3. Qu'est-ce que 2s Orbital
4. Comparaison côte à côte - 1s vs 2s Orbital
5. Résumé
Qu'est-ce que 1s Orbital?
1s orbitale est l'orbitale la plus proche du noyau. Il a la plus faible énergie parmi d'autres orbitales. C'est aussi la plus petite forme sphérique. Par conséquent, le rayon de l'orbitale s est petit. Il ne peut y avoir que deux électrons dans l'orbitale s. La configuration des électrons peut s'écrire 1s 1 , s'il n'y a qu'un seul électron sur l'orbitale s. Mais s'il y a une paire d'électrons, il peut être écrit comme 1s 2 . Alors les deux électrons dans l'orbite s se déplacent dans les directions opposées à cause de la répulsion qui se produit en raison des mêmes charges électriques des deux électrons. Quand il y a un électron non apparié, il est appelé paramagnétique. C'est parce qu'il peut être attiré par un aimant. Mais si l'orbitale est remplie et qu'une paire d'électrons est présente, les électrons ne peuvent pas être attirés par un aimant; c'est ce qu'on appelle diamagnétique.
Qu'est-ce que l'orbitale 2s?
L'orbitale 2s est plus grande que 1s orbitale. Par conséquent, son rayon est plus grand que celui de l'orbitale 1s. C'est la prochaine orbite du placard vers le noyau après 1s orbitale. Son énergie est supérieure à 1s orbitale mais est plus faible que les autres orbitales dans un atome. L'orbite 2s peut également être remplie seulement avec un ou deux électrons. Mais l'orbitale 2s est remplie d'électrons seulement après l'achèvement de 1s orbitale.C'est ce qu'on appelle le principe d'Aufbau, qui indique l'ordre du remplissage des électrons en sous-orbitales.
-> -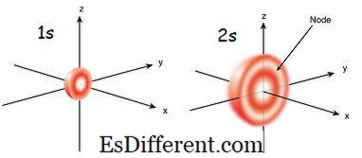
Figure 01: 1s et 2s Orbital
Quelle est la différence entre 1s et 2s Orbital?
- diff Article Moyen avant Table ->
1s vs 2s Orbital |
|
| 1s orbitale est l'orbitale la plus proche du noyau. L'orbitale | 2s est la deuxième orbite la plus proche du noyau. |
| Niveau d'énergie | |
| L'énergie de l'orbitale est supérieure à celle de l'orbitale 2s. | 2s a une énergie comparativement plus faible. |
| Rayon de l'orbite | |
| Le rayon de l'orbite 1 est plus petit. | Le rayon de l'orbite 2 est relativement grand. |
| La taille de l'orbitale | |
| 1s a la plus petite forme sphérique. | 2s orbitale est plus grande que l'orbitale 1s. |
| Remplissage d'électrons | |
| Les électrons sont d'abord remplis dans l'orbitale 1s. | 2s orbital est rempli seulement après achèvement des électrons dans l'orbitale 1s. |
Résumé - 1s vs 2s Orbital
Un atome est une structure 3D contenant un noyau au centre entouré d'orbitales de différentes formes ayant des niveaux d'énergie différents. Ces orbitales sont à nouveau divisées en sous-orbitales selon de légères différences d'énergie. Les électrons, qui est une particule subatomique majeure d'un atome se trouve dans ces niveaux d'énergie. Les sous-orbitales 1 et 2 sont les plus proches du noyau. La principale différence entre les orbitales 1 et 2 est la différence de leur niveau d'énergie, c'est-à-dire que l'orbitale 2s est un niveau d'énergie plus élevé que l'orbitale 1s.
Référence:
1. Libretexts. "Orbitales atomiques. "Chimie LibreTextes. Libretexts, 03 nov. 2015. Web. 26 mai 2017..
2. Atomes, électrons et orbitales. N. p., n. ré. Web. 26 mai 2017..
Courtoisie d'image:
1. "S orbitales" (recadrée) Par CK-12 Fondation - Fichier: Chimie de l'école secondaire. pdf, page 265 (CC BY-SA 3. 0) via Commons Wikimedia


