Différence entre les feuilles plissées Alpha Helix et Beta | Alpha Helix et feuille plissée bêta
Différence clé - Alpha Helix vs feuille bêta plissée
Les hélices alpha et les feuilles plissées bêta sont les deux structures secondaires les plus communément trouvées dans une chaîne polypeptidique. Ces deux composants structuraux sont les premières étapes principales du processus de repliement d'une chaîne polypeptidique. La différence de clé entre Alpha Helix et Beta Pleated Sheet est dans leur structure ; ils ont deux formes différentes pour faire un travail spécifique.
Qu'est-ce que Alpha Helix?
Une hélice alpha est une bobine droite de résidus d'acides aminés sur une chaîne polypeptidique. La gamme de résidus d'acides aminés peut varier de 4 à 40 résidus. Les liaisons hydrogène formées entre l'oxygène du groupe C = O sur la bobine supérieure et l'hydrogène du groupe N-H de la bobine inférieure aident à maintenir la bobine ensemble. Une liaison hydrogène est formée pour chaque quatre résidus d'acides aminés dans la chaîne de la manière ci-dessus. Ce modèle uniforme lui confère des caractéristiques précises telles que l'épaisseur de la bobine et il dicte la longueur de chaque tour complet le long de l'axe de l'hélice. La stabilité de la structure de l'hélice alpha dépend de plusieurs facteurs.

atomes O en rouge, atomes N en bleu et liaisons hydrogène en traits pointillés verts
Qu'est-ce que la feuille bêta plissée?
La feuille bêta plissée, également appelée feuille bêta, est considérée comme la deuxième forme de structure secondaire des protéines. Il contient des brins bêta qui sont reliés latéralement par un minimum de deux ou trois liaisons hydrogène de l'épine dorsale pour former une feuille plissée torsadée comme le montre l'image. Un brin bêta est un tronçon de la chaîne polypeptidique; sa longueur est généralement égale à 3 à 10 acides aminés, y compris le squelette dans une confirmation étendue.
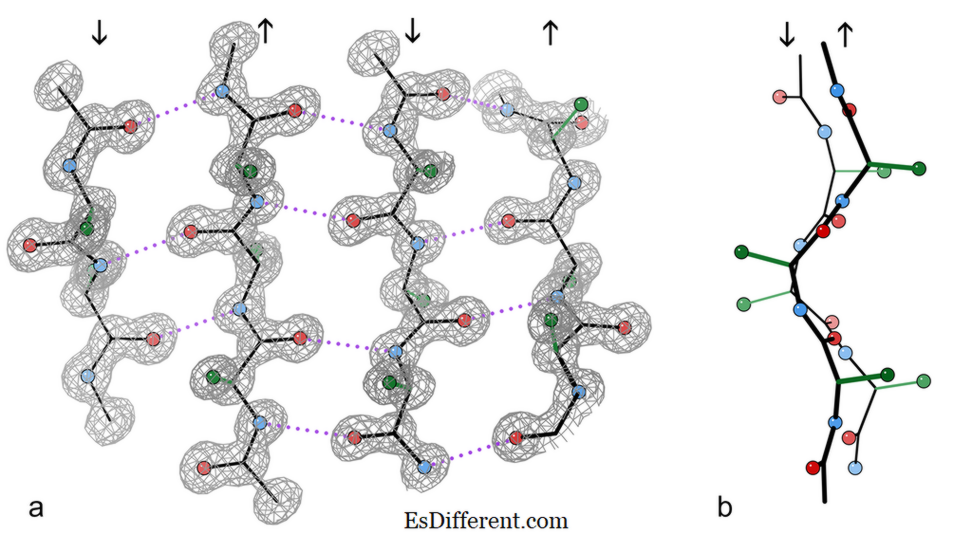
4 brin d'une structure cristalline de l'enzyme catalase.
a) montrant les liaisons hydrogène antiparallèles (pointées) entre les groupes peptides NH et CO sur les brins adjacents. Les flèches indiquent la direction de la chaîne, et les contours de densité électronique décrivent les atomes non-H. Les atomes O sont des boules rouges, les atomes N sont bleus et les atomes H sont omis pour simplifier; les chaînes latérales sont représentées uniquement sur le premier atome de carbone de la chaîne latérale (vert)
b) Vue de côté des deux brins centraux
Dans les feuilles plissées bêta, les chaînes polypeptidiques se chevauchent. Il obtient le nom de "feuille plissée" en raison de l'aspect vague de la structure. Ils sont liés entre eux par des liaisons hydrogène.Cette structure permet de former plus de liaisons hydrogène en étirant la chaîne polypeptidique.
Quelle est la différence entre Alpha Helix et Beta Pleated Sheet?
Structure de l'hélice alpha et de la feuille plissée bêta
Alpha Helix:
Dans cette structure, le squelette polypeptidique est étroitement lié autour d'un axe imaginaire en tant que structure en spirale. Il est également connu sous le nom d'arrangement hélicoïdal de la chaîne peptidique.
La formation de la structure en hélice alpha se produit lorsque les chaînes polypeptidiques sont torsadées en spirale. Cela permet à tous les acides aminés de la chaîne de former des liaisons hydrogène (une liaison entre une molécule d'oxygène et une molécule d'hydrogène) l'une avec l'autre. Les liaisons hydrogène permettent à l'hélice de tenir la forme en spirale et donne une bobine serrée. Cette forme en spirale rend l'hélice alpha très forte.
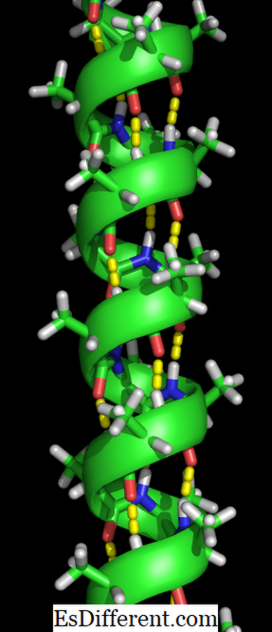
Les liaisons hydrogène sont indiquées par les points jaunes.
Feuille bêta plissée:
Lorsque deux ou plusieurs fragments de chaîne (s) polypeptidique (s) se recouvrent les uns les autres, formant une rangée de liaisons hydrogène les unes avec les autres, on peut trouver les structures suivantes. Cela peut arriver de deux façons. disposition parallèle et disposition anti-parallèle.
Exemples de la structure:
Alpha Helix: Les ongles ou les ongles peuvent être pris comme exemple d'une structure en hélice alpha.
Feuille plissée bêta: La structure des plumes est similaire à la structure de la feuille plissée bêta.
Caractéristiques de la structure:
Alpha Helix: Dans la structure en hélice alpha, il y a 3. 6 acides aminés par tour de l'hélice. Toutes les liaisons peptidiques sont trans et planes et les groupes N-H dans les liaisons peptidiques sont orientés dans la même direction, ce qui est approximativement parallèle à l'axe de l'hélice. Les groupes C = O de toutes les liaisons peptidiques pointent dans la direction opposée, et ils sont parallèles à l'axe de l'hélice. Le groupe C = O de chaque liaison peptidique est lié au groupe N-H de la liaison peptidique formant une liaison hydrogène. Tous les groupes R sont dirigés vers l'extérieur de l'hélice.
Feuille plissée bêta: Chaque liaison peptidique dans la feuille plissée bêta est plane et a la conformation trans. Les groupes C = O et N-H des liaisons peptidiques des chaînes adjacentes sont dans le même plan et se dirigent l'un vers l'autre en formant une liaison hydrogène entre eux. Tous les groupes R dans n'importe quelle chaîne peuvent alternativement se produire au-dessus et au-dessous du plan de la feuille.
Définitions:
Structure secondaire: C'est la forme d'une protéine pliante due à la liaison hydrogène entre ses groupes amide et carbonyle.
Références: "Structure protéique". ChemWiki: La chimie dynamique Hypertext "Structure Secondaire des Protéines: α-Helices and β-Sheets". Protéines. com par Salam Al Karadaghi "Chimie organique". Le Manuel de la Cellule Virtuelle "Beta Sheet". Wikipédia Image Courtesy: "Helix densité électronique myoglobin 2nrl 17-32" Par Dcrjsr - Propre travail (CC BY 3. 0) via Commons Wikimedia "Structure secondaire de protéines" par en: Utilisateur: Bikadi (CC BY-SA 3. 0) Commons Wikimedia "1gwe antipar bêta Sheet both" par Dcrjsr - Propre travail (CC BY 3.0) via Commons Wikimedia


