Différence entre les composés ioniques et covalents | Composés ioniques vs composés covalents
différence clé - ionique vs covalent composés
de nombreuses différences peuvent être observées entre les composés ioniques et covalentes en fonction de leurs propriétés macroscopiques telles que la solubilité dans l'eau, la conductivité électrique, les points de fusion et les points d'ébullition. La principale raison de ces différences est la différence dans leur modèle de liaison. Par conséquent, leur motif de liaison peut être considéré comme la différence clé entre composés ioniques et covalents. (différence entre les liaisons ioniques et covalentes) Lorsque des liaisons ioniques sont formées, les électrons sont donnés par un métal et les électrons donnés sont acceptés par un métal non métallique. Ils forment un lien fort en raison de l'attraction électrostatique. Les liaisons covalentes sont formées entre deux non-métaux. En liaison covalente, deux atomes ou plus partagent des électrons pour satisfaire la règle de l'octet. Généralement, les liaisons ioniques sont plus fortes que les liaisons covalentes. Cela conduit à des différences dans leurs propriétés physiques.
Qu'est-ce que les composés ioniques?
Les liaisons ioniques se forment lorsque deux atomes ont une grande différence dans leurs valeurs d'électronégativité. Dans le processus de formation de la liaison, le moins électron électron des pertes électron (s) et plus atome électronégatif gagne ces électron (s). Par conséquent, les espèces résultantes sont des ions chargés de manière opposée et ils forment une liaison en raison de la forte attraction électrostatique.
Les liaisons ioniques se forment entre les métaux et les non-métaux. En général, les métaux n'ont pas beaucoup d'électrons de valence dans la coquille la plus externe; cependant, les non-métaux ont plus de huit électrons dans la coquille de valence. Par conséquent, les non-métaux ont tendance à accepter les électrons pour satisfaire la règle de l'octet.
Exemple de composé ionique est Na + + Cl - à NaCl
sodium (métal) ne comporte qu'un seul électron de valence et de chlore (non métalliques) a sept électrons de valence.

Qu'est-ce qu'un composé covalent?
Les composés covalents sont formés en partageant des électrons entre deux atomes ou plus pour satisfaire la "règle d'octet". Ce type de liaison se trouve couramment dans les composés non métalliques, les atomes du même composé ou les éléments voisins dans le tableau périodique. Deux atomes ayant presque les mêmes valeurs d'électronégativité n'échangent pas (donner / recevoir) des électrons de leur enveloppe de valence. Au lieu de cela, ils partagent des électrons pour obtenir la configuration d'octet.
Des exemples de composés covalents sont le méthane (CH 4 ), le monoxyde de carbone (CO), d'iode monobromure (IBR)
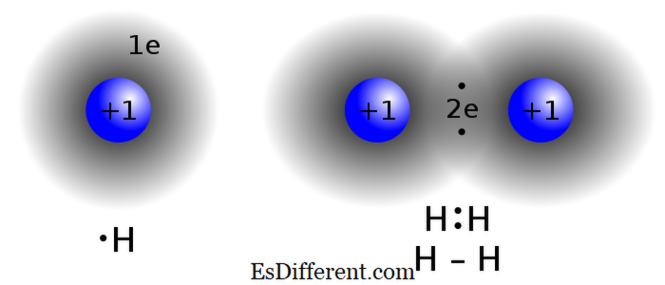
liaison covalente
Quelle est la différence entre ionique et covalente Composés?
Définition des composés ioniques et des composés covalents
Composé ionique: Le composé ionique est un composé chimique de cations et d'anions qui sont maintenus ensemble par des liaisons ioniques dans une structure en réseau.
Composé covalent: Le composé covalent est une liaison chimique formée par le partage d'un ou plusieurs électrons, en particulier des paires d'électrons, entre des atomes.
Propriétés des composés ioniques et covalents
Propriétés physiques
Composés ioniques:
Tous les composés ioniques existent sous forme de solides à température ambiante.
Les composés ioniques ont une structure cristalline stable. Par conséquent, ils ont des points de fusion et des points d'ébullition plus élevés. Les forces d'attraction entre les ions positifs et négatifs sont très fortes.
- diff Article Milieu avant Tableau ->| Composé ionique | Apparence | Point de fusion |
| NaCl - Chlorure de sodium | Solide cristallin blanc | 801 ° C |
| KCl - Chlorure de potassium | Cristal vitreux blanc ou incolore | 770 ° C |
| MgCl 2 - Chlorure de magnésium | Solide cristallin blanc ou incolore | 1412 ° C |
Composés covalents Les composés covalents existent sous les trois formes; comme solides, liquides et gaz à température ambiante.
Leurs points de fusion et d'ébullition sont relativement faibles par rapport aux composés ioniques.
Composé covalent
| Apparence | Point de fusion | HCl-Chlorure d'hydrogène |
| Un gaz incolore | -114. 2 ° C | CH |
| 4 -Méthane Un gaz incolore | -182 ° C | CCl |
| 4 - Tétrachlorure de carbone Un liquide incolore < -23 ° C | Conductivité | Composés ioniques: |
Les composés ioniques solides n'ont pas d'électrons libres; par conséquent, ils ne conduisent pas l'électricité sous forme solide. Mais quand les composés ioniques sont dissous dans l'eau, ils font une solution qui conduit l'électricité. En d'autres termes, les solutions aqueuses de composés ioniques sont de bons conducteurs électriques.
Composés covalents: Ni les composés covalents purs ni les formes dissoutes dans l'eau ne conduisent pas l'électricité. Par conséquent, les composés covalents sont de mauvais conducteurs électriques dans toutes les phases.
Solubilité Composés ioniques:
La plupart des composés ioniques sont solubles dans l'eau, mais ils sont insolubles dans les solvants non polaires.
Composés covalents: La plupart des composés covalents sont solubles dans les solvants non polaires, mais pas dans l'eau.
Dureté Composés ioniques:
Les solides ioniques sont des composés plus durs et plus fragiles.
Composés covalents: Généralement, les composés covalents sont plus mous que les solides ioniques.
Courtoisie avec l'image: "Covalent bond hydrogen" par Jacek FH - Propre travail. (CC BY-SA 3. 0) via Commons "IonicBondingRH11" par Rhannosh - Propre travail. (CC BY-SA 3. 0) via Wikimedia Commons


