Différence entre les alcanes et les alcènes | Alkanes vs Alkène
Différence clé - Alcanes et Alkenes
Les alcanes et les alcènes sont deux types de familles d'hydrocarbures qui contiennent du carbone et de l'hydrogène dans leur structure moléculaire. La principale différence entre les alcanes et les alcènes est leur structure chimique; sont des hydrocarbures saturés de formule générale générale de C n H 2n + 2 et les alcènes sont considérés comme un groupe hydrocarboné insaturé puisqu'ils contiennent une double liaison entre deux atomes de carbone atomes. Ils ont la formule moléculaire générale de C n H 2n.
Quels sont les alcanes?
Les alcanes ne contiennent que des liaisons simples entre les atomes de carbone et d'hydrogène (liaisons C-C et liaisons C-H). Par conséquent, ils sont appelés "hydrocarbures saturés". Selon le modèle d'hybridation orbitale, tous les atomes de carbone d'Alkenes ont l'hybridation SP 3 . Ils forment des liaisons sigma avec des atomes d'hydrogène, et la molécule résultante a la géométrie d'un tétraèdre. Les alcanes peuvent être subdivisés en deux groupes selon leurs arrangements moléculaires; les alcanes acycliques (C n H 2n + 2 ) et les alcanes cycliques (C H 2n ).

Les alcènes sont les hydrocarbures, contenant une double liaison carbone-carbone (C = C).
"Oléfines" est l'ancien nom utilisé pour désigner la famille des alcènes. Le plus petit membre de cette famille est l'éthane (C 2 H 4 ); il a été appelé olefian t gas (en latin: oleum signifie «pétrole») signifie signifie «faire») dans les premiers jours. En effet, la réaction entre C 2 H 4 et le chlore donne C 2 H 2 Cl pétrole.

Alcanes:
Les alcanes ont la formule moléculaire générale C
n H 2n + 2. Le méthane (CH 4 ) est le plus petit alcane. - diff Article Milieu avant Tableau -> Nom
Formule chimique| Structure acyclique | Méthane | CH |
| 4 | CH 4 | Ethane C 2 |
| H | 6 CH 3 CH | 3 Propane C 3 |
| H | 8 CH 3 CH | 2 CH 3 Butane C 4 |
| H | 10 CH 3 CH 2 | CH 2 CH 3 Pentane C 5 H |
| 12 | CH 3 CH 2 | CH 2 CH 2 CH 3 Hexane C 6 14 |
| CH | 3 CH 2 CH | 2 CH 2 CH 2 CH 3 Heptane C 7 H 16 |
| CH | 3 CH 2 CH | 2 CH 2 CH 2 CH 2 CH 3 Octane C 8 H 18 CH |
| 3 | CH 3 CH 2 | CH 2 CH 2 CH 2 CH 3 CH 3 Alkenes: Les alcènes ont la formule chimique générale de C n H 2n .Les alcènes sont considérés comme des hydrocarbures insaturés, car ils ne contiennent pas le nombre maximum d'atomes d'hydrogène pouvant appartenir à une molécule d'hydrocarbure. Nom |
Formule chimique Structure Ethène C 2 H
| 4 | CH | 2 = |
| CH | 2 Propène C 3 | H 6 CH 3 |
| CH = CH | 2 Butène C 4 | H 8 CH 2 = |
| CHCH | 2 CH 3 CH | 3 CH = CHCH Pentene C 5 H 10 CH 2 = CHCH |
| 2 | CH 2 CH 3 | CH 3 CH = CHCH 2 CH 3 Hexène C 6 H CH 2 CHCH 2 |
| CH | 2 CH 2 CH | 3 CH 3 CH CH 3 CH 3 CH 2 CH = CHCH 2 CH 3 Heptène C
7 H 14 CH 2 CH 2 CH 2 CH |
| 2 | CH 3 CH 3 | CH = CH < 2 CH 2 CH 2 CH 2 CH 3 Propriétés chimiques des alcanes et alcènes Alcanes: Réactivité: Les alcanes sont inertes vis-à-vis de nombreux réactifs chimiques. C'est parce que les liaisons carbone-carbone (C-C) et carbone-hydrogène (C-H) sont assez fortes puisque les atomes de carbone et d'hydrogène ont presque les mêmes valeurs d'électronégativité. Par conséquent, il est très difficile de briser leurs liens, à moins qu'ils ne soient chauffés à des températures assez élevées. Combustion: Les alcanes peuvent facilement brûler dans l'air. La réaction entre les alcanes avec l'excès d'oxygène est appelée "combustion". Dans cette réaction, les alcanes se transforment en dioxyde de carbone (CO 2 ) et en eau. C n H 2n + (n + n / 2) 0 2 2 |
0
C 4
H
10
+ 13/2
2 4 CO 2
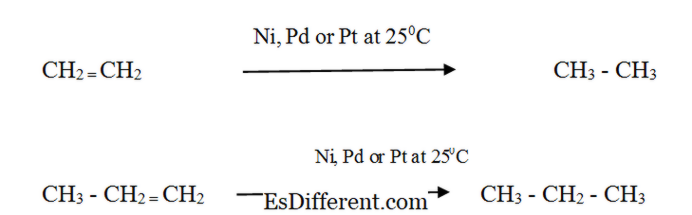
+ 5H 2 O Butane Oxygène Dioxyde de carbone Eau Les réactions de combustion sont des réactions exothermiques (dégageant de la chaleur). En conséquence, les alcanes sont utilisés comme source d'énergie. Alcènes: Réactivité: Les alcènes réagissent avec l'hydrogène en présence d'un catalyseur métallique finement divisé pour former l'alcane correspondant. Le taux de réaction est très faible sans catalyseur. L'hydrogénation catalytique est utilisée dans l'industrie alimentaire pour convertir les huiles végétales liquides en graisse semi-solide en margarine et graisse grasse solide. Propriétés physiques des alcanes et des alcènes Formes Alcanes:
Les alcanes existent sous forme de gaz, de liquides et de solides. Le méthane, l'éthane, le propane et le butane sont des gaz à température ambiante. Les structures non ramifiées de l'hexane, du pentane et de l'heptane sont des liquides. Les alcanes qui ont un poids moléculaire plus élevé sont des solides. CH 4 à C 4 H 10 sont des gaz C 5 H
12
à Liquides
Les alcanes de masse moléculaire plus élevée sont des solides mous
Alkenes
Les alcènes présentent des propriétés physiques similaires de l'alcane correspondant. Les alcènes qui ont des masses moléculaires inférieures (C 2
H 4 à C 4 H 8 ) sont des gaz à la température ambiante et à la pression atmosphérique.Les alcènes ayant un poids moléculaire plus élevé sont des solides.
Solubilité: Alcanes: Les alcanes ne se dissolvent pas dans l'eau. Ils sont dissous dans des solvants organiques non polaires ou faiblement polaires. Alcènes: Les alcènes sont des molécules relativement polaires dues à la liaison C = C; par conséquent, ils sont solubles dans des solvants non polaires ou des solvants de faible polarité. L'eau est une molécule polaire et les alcènes sont légèrement solubles dans l'eau. Densité: Alcanes: Les densités des alcanes sont inférieures à la densité de l'eau. Leur valeur de densité est proche de 0. 7 g mL -1 , compte tenu de la densité de l'eau à 1. 0 g mL
-1 . Alkenes: Les densités d'Alkenes sont inférieures à la densité de l'eau. Points d'ébullition: Alcanes: Le point d'ébullition des alcanes non ramifiés augmente doucement à mesure que le nombre d'atomes de carbone et le poids moléculaire augmentent. En général, les alcanes ramifiés ont des points d'ébullition inférieurs par rapport aux alcanes non ramifiés, ayant le même nombre d'atomes de carbone. Alkenes : Les points d'ébullition sont similaires aux alcanes correspondants avec une petite variation. Références:
CliffsNotes. (n ° d.). Récupéré le 06 juillet 2016, à partir d'ici.
Propriétés physiques des alcanes. (2013). Récupéré le 06 juillet 2016, à partir d'ici Zum Directory-modus. (n ° d.). Récupéré le 06 juillet 2016, d'ici
Propriétés chimiques des alcanes: Wizznotes. GCSE et CXC gratuits: Tutorials, Past Papers et Quiz. (n ° d.). Récupéré le 06 juillet 2016, à partir d'ici Polarity. (n ° d.). Récupéré le 06 juillet 2016, à partir d'ici
Moments dipolaires. (2013). Récupéré le 06 juillet 2016, d'ici
Isomère structural. (n ° d.). Récupéré le 06 juillet 2016, à partir d'ici Une introduction aux alcènes. (n ° d.). Récupéré le 06 juillet 2016, à partir d'ici Courtoisie avec l'image: "Alkene names" Par Chris Evans - (CC0) via Commons Wikimedia Public Domain) via Commons Wikimedia




