Différence entre la traduction de Nick et l'extension d'amorce | Nick Translation vs Extension Primer
Différence clé - Nick Translation vs Primer Extension
La traduction de Nick et l'extension d'amorce sont deux techniques importantes en biologie moléculaire. La différence clé entre la traduction de coupure et l'extension d'amorce est que le processus de traduction de coupure produit des sondes marquées pour d'autres techniques d'hybridation tandis que la méthode d'extension d'amorce identifie une séquence d'ARN spécifique d'un mélange et révèle des informations sur l'expression de l'ARNm. Les deux techniques ont une grande importance et sont couramment effectuées dans les laboratoires de recherche moléculaire.
TABLE DES MATIÈRES
1. Vue d'ensemble et différence clé
2. Qu'est-ce que Nick Translation
3. Qu'est-ce que Primer Extension
4. Comparaison côte à côte - Nick Translation vs Primer Extension
5. Résumé
Qu'est-ce que Nick Translation?
La traduction de Nick est une technique importante utilisée pour préparer des sondes marquées pour diverses techniques de biologie moléculaire telles que le buvardage, l'hybridation in situ, l'hybridation in situ fluorescente etc. C'est un méthode in vitro de marquage de l'ADN. Des sondes d'ADN sont utilisées pour identifier des séquences d'ADN ou d'ARN spécifiques. A l'aide d'une sonde marquée, des fragments spécifiques peuvent être marqués ou visualisés à partir d'un mélange complexe d'acide nucléique. Par conséquent, les sondes marquées sont préparées en utilisant diverses techniques à utiliser pour différentes techniques. La traduction de Nick est une de ces méthodes qui produit des sondes marquées à l'aide d'enzymes DNase 1 et d'ADN polymérase 1.

Qu'est-ce que l'extension Primer?
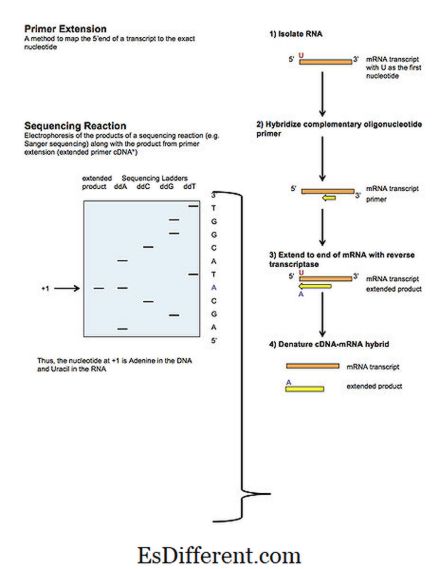
L'extension d'amorce est une technique qui est utilisée pour trouver la séquence d'ARN spécifique à partir d'un mélange d'ARN et localiser l'extrémité 5 'du transcrit d'ARNm. Il est également utilisé pour étudier la structure de l'ARN et de l'expression. La méthode d'extension d'amorce est réalisée avec des amorces marquées ou avec des nucléotides marqués. Si des amorces marquées sont utilisées, cela exclut la nécessité de marquer les nucléotides qui sont utilisés pour la synthèse de l'ADNc. Il y a plusieurs étapes dans cette technique. Il commence par l'extraction de l'ARN de l'échantillon. Ensuite, une amorce oligonucléotidique marquée est ajoutée au mélange avec les ingrédients nécessaires pour synthétiser l'ADNc d'une séquence d'ARN spécifique. L'amorce s'hybride avec la séquence complémentaire du mélange. En utilisant la séquence recuite d'amorce comme matrice, l'enzyme transcriptase inverse synthétise l'ADN complémentaire (ADNc) de la séquence d'ARN. L'hybridation d'amorce et la transcription inverse se produisent uniquement lorsque la séquence d'ARN spécifique est présente dans l'échantillon. Enfin, lorsque l'électrophorèse sur gel dénaturant est effectuée, la taille de la séquence d'ARN peut être déterminée. Il est également facile de trouver la base +1 de la séquence d'ARNm (site d'initiation de la transcription) par la méthode d'extension de l'amorce. La quantité d'ARNm présent dans l'échantillon peut être quantifiée par cette méthode si une amorce en excès est utilisée.
Figure 02: Extension Primer
Quelle est la différence entre la traduction Nick et l'extension Primer?
- diff Article Milieu avant Table ->
Nick Translation vs Primer Extension
La traduction de Nick est un processus qui crée des sondes d'ADN marquées pour diverses réactions d'hybridation. |
|
| L'extension d'amorce est une technique utilisée pour trouver l'ARN spécifique ou pour étudier l'expression des gènes. | Enzymes Utilisées |
| DNase 1 et enzymes ADN polymérase sont utilisées. | |
| L'enzyme transcriptase inverse est utilisée. | Importance |
| La traduction de Nick facilite le marquage de la séquence d'ADN spécifique. | |
| L'extension d'amorce permet de détecter la taille de la séquence d'ARNm spécifique et la quantité présente dans l'échantillon. | Résumé - Nick Translation vs Primer Extension |
La traduction de Nick est une méthode utilisée pour synthétiser des sondes marquées basées sur les activités des enzymes DNase 1 et
E coli ADN polymérase 1. C'est une méthode in vitro employée dans les laboratoires avant différentes techniques d'hybridation. Au cours de la translation de coupure, l'activité d'exonucléase 5'-3 'de l'ADN polymérase 1 élimine les nucléotides avant l'activité nick et polymérase de l'ADN polymérase 1 remplace les nucléotides retirés par des nucléotides marqués derrière la coupure. L'extension d'amorce est une méthode qui est utilisée pour détecter un transcrit d'ARN spécifique à partir d'un mélange et quantifier la taille et la quantité d'ARN d'intérêt. C'est la différence entre la translation de coupure et l'extension d'amorce. Références
1. Reid, Alex. "Traduction de Nick. "Springer. N. p., n. ré. Web. 18 avr. 2017
2. "Extension Primer. "Diagnostics nationaux. N. p., n. ré. Web. 19 avril 2017
3. Kuo, M. T. et W. Plunkett."Nick-traduction des chromosomes métaphase: marquage in vitro des régions nucléosensibles à l'hypersensibilité dans les chromosomes. "Actes de l'Académie nationale des sciences des États-Unis d'Amérique. U. S. Bibliothèque nationale de médecine, février 1985. Web. 19 avril 2017
4. Raymond et al. "Dosage quantitatif simple par PCR d'amorce pour la surveillance directe des microARN et des ARN interférents courts. "ARN. Copyright 2005 par RNA Society, novembre 2005. Web. 19 avr. 2017
Courtoisie d'image:
1. "Primer Extension Assay" Par Jjnmmnjj - Propre travail (CC BY-SA 3. 0) via Commons Wikimedia




